碳元素, 自然很常见但你确实了解它吗

碳是6号元素的华文称呼,左证它的拉丁文称呼音译,我国先译作炭,这是古代就有的字,读tàn。名词,义为木柴燃后之物。自后左证文化部门章程,把固体非金属元素的称呼调解为石字偏旁,我国又为此专诚新造了这个形声字,仍读此音。碳元素生成于恒星演化核耗损阶段的氢耗损和氦耗损两种流程中;在地壳中,镭223、镭224和氡224,都可通过超非对称裂变产生碳14。寰宇品貌1.0101×107,居第4位;地壳品貌480g/t,居第15位。在化学元素周期表中,碳属于p区ⅣA族第二周期的褂讪性非金属固体元素。碳在邃古期间就被人们发现了。古代的中国人还曾期骗它和硫、硝石参与了炸药的要紧发明,但是欧洲人最早并未把碳行动一种元素,而是看作一种隧道的“燃素”。直到1789年,法国化学家拉瓦锡才第一次明确指出碳是一种元素,并把它包摄于能氧化和成酸的非金属物资。这是人类发现的第一种元素,拉瓦锡为其定名的拉丁文称招呼carbonium。真名来自英文carbon,风趣风趣是“煤炭”;并用拉丁文称呼第一个字母的大写体作为它的元素符号———C。

2存在局势
碳属于亲氧元素,在自然界里呈单质与化合物两种局势存在。单质主要存在于无定形碳、石墨和金刚石中;化合物分为两大类,一类以有机物局势主要存在于煤、石油、沥青、自然气、可燃冰和一切生物体中,另一类以无机物局势主要存在于石灰岩、大理岩、方解石、白云石、毒重石、菱镁矿、菱锰矿、菱铁矿、菱锌矿、白铅矿、碳酸锶矿、油母页岩和大气层的二氧化碳中。我国不仅有1.3万亿吨的煤储量,况且领有质地最佳的产自宁夏汝其沟的无烟煤。它具有特低硫、特低磷、特低灰,最高发烧量的显耀特色,1t煤可发出35.59GJ(850万千卡)的热量碳有,却仅产生种自然同位素1kg的煤渣称呼。符号及所占百分率区别是碳12C)占98.89%,
3,、:12(碳13(13C)占1.11%,碳14(14C)仅占万亿分之一。其中碳14为辐照性同位素,仅痕量存在。另外还有12种人造辐照性同位素,质地数为8~11和15~22。
碳的同素异形骸有石墨、金刚石、无定形碳、球碳和单层碳纳米管。其中球碳又称富勒烯,都是偶数分子,包括C44、C50、C60、C70、C74、C80、C84、C120等;而无定形碳又细分为炭黑、柴炭、焦炭、骨炭与活性炭。谢寰球上,石墨的主要产地在中国、西伯利亚和朝鲜半岛,自然金刚石的三大产地是扎伊尔、俄罗斯和南非。
3物感性质
子量12.0807碳的原子半径,原子体积(共价半径5.30cm)773pm,离子电阻率半径15pm(+4)、260密度pm(-4);3原,硬度为1°;比热容为711J/(kg·K/)mol,熔点为;3550℃1375.0,μ沸点为Ω/cm4827℃;2.267。g/cm
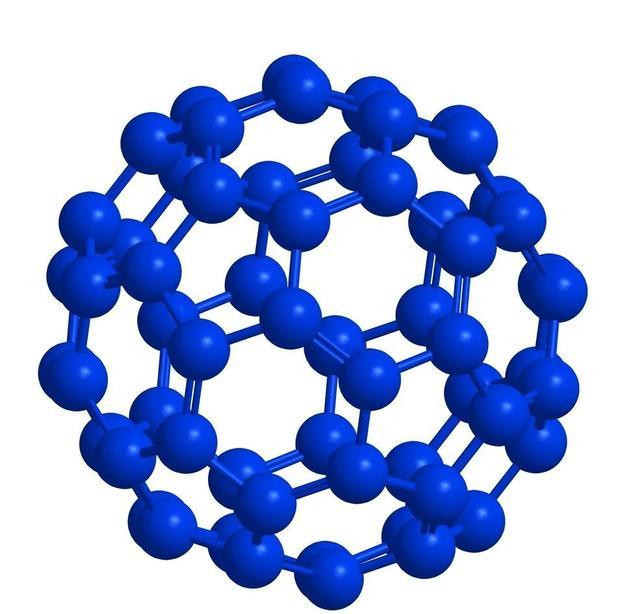
碳的各式同素异形骸中,金刚石为网状结构的原子晶体,石墨为细鳞片形层状结构晶体单层和多层之分,碳纳米管为齐心螺旋圆柱体结构,又有管端的启齿和封口之别,;直径约富勒烯则是由几十个至几百个碳1nm,长可达1μm,既有原子构成的分子晶体空腹球结构;无定形碳莫得固定的体式和周期性结构规定,大部分都是由石墨层状结构的分子碎屑无执法地堆在一齐形成的固体。金刚石无色,是绝缘体;硬度10级,虽为元素单质之最,但是在阳光下,若把它放在一个密闭的玻璃器皿内,也曾聚光镜聚焦后发出的强光照耀,当温度升高到900℃以上时,便能化作一缕青烟———无色的二氧化碳气体而褪色。虽不导电,热导率却是金属铜的6倍。石墨玄色,晶体很软,是导电体,况且导电性能与其结构联系极大,石墨六元环地方平面的电导率是垂直标的的5000倍;导热性不仅高于其他非金属,以致比某些金属还高。将金刚石阻隔空气加热,不错振荡为石墨;在超高蔼然超高压条目下,也可将石墨变成金刚石。单层纳米管具有金属导电性或半导体性能踱步在大气中的紫红色。,C球碳在固体时均呈玄色70为酒红色CO,,给太阳的短波辐射掀开绿灯C76为黄绿色,但在液体时则因分子不同色彩差异……球碳C60分子在,使之疏通无阻地去加热大地-245℃以下具有超导性:比如C60为。,2
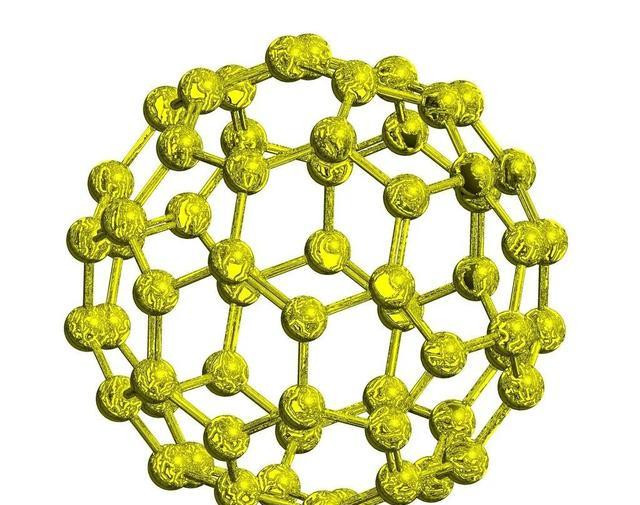
给各式生物带来蔼然和能量;但它却谢却大地升温后发出的长波辐射通行,因而形成了大气对流层的温室效应,为地球生命的养殖重生,创造了相比优胜的条目。期骗钠作复原剂,在400℃和800个大气压的条目下,二氧化碳在12个小时内,就有7.3%变成石墨,8.9%变成金刚石。
4化学性质
碳的价电子构型2s22p2,电负性2.5,第一电子亲和能122.555kJ/mol,第一电离能1086kJ/mol,顺次电极势-0.200V;氧化数+4、-4、+2,常见化合价+4、-4。
碳在常温下的化学性质并不开朗,也不溶于水,但其化学开朗性能随温度的加多而赶紧地大幅度普及,迥殊是气态时愈加开朗。它不仅自不息洽的材干很强,既可形成单键和双键,又可形成叁键,既可贯串成链和环,又可贯串成网;况且与其他元素的原子,有的也不错形成单键、双键和叁键,并因可弃取多种杂化轨道,既可形成直线形和正四面体,又可形成平面三角形。它与s区金属ⅢA族金属,可形成离子型碳化物;与跟我方电负性一样和邻近的元素,能以共价键形成原子型碳化物;与d区过渡金属,多数以充填金属晶体晶格舛错的花样形成金属型碳化物;仅参与形成的有机化合物就高达1000多万种。
碳是酸性元素,溶于一般的碱,不溶于强碱,也不溶于稀酸和有机溶剂,但石墨却能与硝酸和高氯酸响应,也溶于某些熔融的金属中。高价氧化物为弱酸性,溶于水生成碳酸。
碳的化合物类型最多,在无机化合物中,主要包括碳化物、氧化物、碳酸盐;在有机化合物中,主要包括碳氢化合物以及糖、醇、醛、酯、醚、酮、酚、烯、
(葡萄糖腈等C6H在核响应方面。6)常、(C氰见H化[(OCN合,)物)2辐照性同位素碳有]、:二氧化碳甲烷(CH(CO144)、在放出)、乙碳酸炔β、-(C(射线后衰变成氮镁2HH、2CO2氧等元素的合成)、3)乙、碳酸钙醇(14C2。H(CaCO6;况且碳还O在星际)、3)苯、
6126等。2
在恒星演化的碳耗损流程中,区别参与了钠、氖
气体里因被高能质子和高能α粒子犀利撞击,区别裂解成了氦3、氦4、锂6、锂7、铍9和硼10。碳12在人造85号元素砹、87号元素钫、98号元素锎和99号元核辐射衰变为其他元素素锿时,都充任过“炮弹。”它们的半衰期限制的变装。而被人造出的,从8C12的2种辐照性同位素zs(仄秒,仄为,10都可通过-21的数目级,即10万亿亿分之一)到11C的20.334min。

5主要用途
①金刚石因高熔点和高硬度身无弃物,透明者加工成腾贵的首饰和笼罩品,不透明者制成钻头和切割器具,二者加工时的粉末作研磨材料。
②平素石墨用来制造坩埚、电极、电刷、干电板、冷凝器、高温热电偶、润滑剂、色彩和铅笔芯;高纯度的石墨用作核响应堆的中子延缓剂、防射线材料和火箭发动机喷嘴,也用于寰宇飞船和导弹部件;石墨粉涂在军用飞机上层,能将不同频率的微波能量振荡为机械能、电能或热能,从而变成隐身飞机,使仇敌的雷达变成“盲人”;石墨炸弹不仅可杂乱敌方防空和发电拔擢,况且对停在跑道上的飞机、发电厂的电网和电子拔擢,都能形成迥殊严重的杂乱。
③半衰期5730年的碳14,在归天后的生物体中只减不增,期骗它在生物遗体和化石中的残留量额外所占比例的变化,可估算出该生物存活的年代,被誉为
“考古的时钟”。
④石油是碳化合物的仓库,可提炼出1000多种居品,比如石油气、汽油、煤油、柴油、润滑油、溶剂油、凡士林、重油、石蜡、沥青、乙烯等;煤炭也不仅
仅用作燃料,还可制造出很多化工居品。
⑤自然气除径直作为工业和民用燃料,其主要要素甲烷还可索要氢气,制造化工原料氯仿、乙炔和四氯化碳;其他要素乙烷、丙烷、丁烷,均是很好的化工原料。
⑥固体二氧化碳用作制冷剂、食物保鲜剂,也用于人工降雨和低温现实室;气体二氧化碳既可作工业原料、温室肥料、熄灭材料,又可加入啤酒和汽水,还可用作分子气体激光器的材料;在石油设备中,与水一齐注入井内,既可普及采油率,又能用作洗井剂。而其最大孝顺则是挨三顶五地供给绿色植物在光伙同用中制造有机物资所需的精深原材料。
⑦碳纤维强度大、质地轻、耐高温、抗疲倦、抗腐蚀,常用于制造飞机、汽车部件,火箭、导弹的发动机和鼓吹器,也用来制造撑杆、垂钓竿、网拍子、高尔夫球杆等器材;活性炭多孔而坚忍,具有很强的吸附作用,可用来净化某些气体和液体,不仅用于防毒面具,还不错裁撤糖浆里的色素,裁撤工业用水和民用水中的无益物资和臭味,也用来防治肠道疾病。
⑧具有中空结构的碳纳米管,可作为高效储氢器,它的储氢密度以致比液态氢和固态氢还高,况且使用氢时,稍加热就可开释出来;期骗碳纳米管的超细性,还不错当先灌入其他物资,然后







